 |
| ||
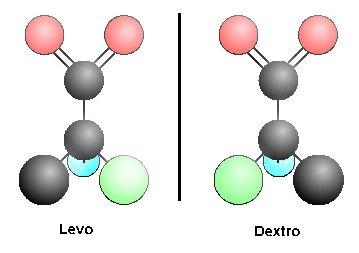
Figura 1. Duas formas de imagens especulares (enantioméricas
oo esstereoisoméricas) da mesma molécula não podem ser
superpostas sem a quebra de uma ligação covalente. As moléculas
são chamadas Levo (esquerda ou l)
ou Dextro (direita ou d) por causa
da direção em que cada uma gira o plano da luz polarizada que
passa por uma solução do composto. As duas formas são idênticas
em propriedades químics, mas diferentes em suas propriedades físicas,
como resultado do posicionamento dos átomos em torno do centro opticamente
ativo, neste caso, um átomo de carbono assimétrico.
É assimétrico porque todas quatro ligações covalentes
se conectam com um radical diferente ou um átomo diferente, e como conseqüência
da estrutura tetraédrica do átomo de carbono. moléculas
que são imagens especulares uma da outra são possíveis.
Quando este composto é sintetizado em laboratório, a síntese
resulta em quantidades iquais de formas levógiras e destrógiras
(uma mistura racêmica). Em sistemas vivos, apenas as formas l
de aminoácidos e as formas d de açucares
são usadas. Os sistemas biológicos e sistemas biologicamente derivados
(enzimas) podem distinguir enantiômeros, enquanto processos químicos
e muitos processos físicos não podem distinguí-los. Com
o passar do tempo, a atividade térmica pode quebrar ligações
de maneira que a forma única (em sistemas biológicos, aminoácidos
l) é gradualmente convertido em uma mistura
racêmica (quantidades iguais das forms d- e
l- ).
Traduzido por Urias Echerhoff Takatohi em 24-03-2003